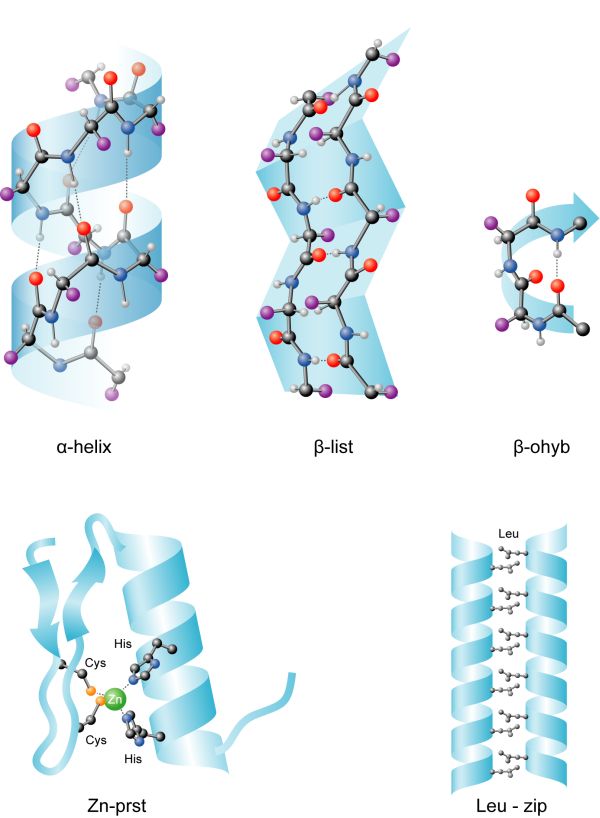
bílkoviny - periodické motivy {1}
charakteristické prostorové útvary, které může zaujímat peptidový řetězec v bílkovinách. Tento modernější pojem postupně vytlačuje starší pojem „sekundární struktura” (viz prostorová struktura biopolymerů). K nejrozšířenějším periodickým motivům patří:α-helix, jeden závit pravotočivé šroubovice tvoří 3,6 aminokyselinových zbytků. Tento typ helixu je stabilizován vnitrořetězcovými
vodíkovými můstky, spojující CO a NH skupiny v sousedních závitech šroubovice. U některých globulárních bílkovin (např.
hemoglobin) může až 75 % peptidového řetězce zaujímat tuto strukturu. V bílkovinách, zejména pak strukturních (např.
kolageny) mohou existovat i jiné typy helixů.
β-struktura, další z běžných typů periodických struktur. Peptidový řetězec probíhá více-méně lineárně, přičemž postranní řetězce aminokyselin míří střídavě na jednu a druhou stranu. Tato struktura bývá stabilisována buď interakcí s α-helikálními úseky (tzv. supersekundární struktury, např. αβα) nebo s paralelně či antiparalelně probíhajícím polypeptidovým řetězcem (nebo řetězci) stejné
konformace, s nímž je spojen vodíkovými můstky. Tak vznikají struktury zvané β-skládaný list (angl. β-pleated sheet); jejich plocha bývá různým způsobem zakřivena.
β-ohyb, angl. β-bend nebo β-turn, charakteristická struktura globulárních bílkovin, kdy se řetězec ohýbá do protisměru a stabilisuje se vodíkovým můstkem s
peptidovou vazbou, ležící o tři aminokyselinové zbytky dále.
zinkové prsty, jeden z charakteristických motivů bílkovin, vážících se na
DNA; je stabilisován ionty Zn
2+, které se na protein váží prostřednictvím zbytků
cysteinu nebo
histidinu.
leucinový zip, motiv pomocí něhož některé bílkoviny vytvářejí dimery; je znám zejména u proteinů, vážících se na
DNA. Vytvářejí jej dva α-helixy, u nichž je každý sedmý aminokyselinový zbytek
leucin; tím na jedné straně helixu vzniká hydrofobní povrch a dva takové helixy mohou zprostředkovat reversibilní hydrofobní vazbou dimerisaci podjednotek.